IMAGENES DEL TEMA :)
BIOLOGIA !
miércoles, 24 de octubre de 2012
REACCIONES QUIMICAS :Una reacción química, cambio químico o fenómeno químico, es todo proceso termodinámico en el cual una o más sustancias (llamadas reactantes), por efecto de un factor energético, se transforman, cambiando su estructura molecular y sus enlaces, en otras sustancias llamadas productos. Esas sustancias pueden ser elementos o compuestos. Un ejemplo de reacción química es la formación de óxido de hierro producida al reaccionar el oxígenodel aire con el hierro de forma natural, o una cinta de magnesio al colocarla en una llama se convierte en óxido de magnesio, como un ejemplo de reacción inducida.
A la representación simbólica de las reacciones se les llama ecuaciones químicas.
Los productos obtenidos a partir de ciertos tipos de reactivos dependen de las condiciones bajo las que se da la reacción química. No obstante, tras un estudio cuidadoso se comprueba que, aunque los productos pueden variar según cambien las condiciones, determinadas cantidades permanecen constantes en cualquier reacción química. Estas cantidades constantes, las magnitudes conservadas, incluyen el número de cada tipo de átomo presente, la carga eléctrica y la masa total.
ECUACION QUIMICA: Una ecuación química es una descripción simbólica de una reacción química. Muestra las sustancias que reaccionan (llamadas reactivos o reactantes) y las sustancias que se obtienen (llamadas productos). También indican las cantidades relativas de las sustancias que intervienen en la reacción.
Se utilizan para describir lo que sucede en una reacción química en sus estados inicial y final. En ella figuran dos miembros; en el primero, lossímbolos o fórmulas de los reactivos y en el segundo los símbolos o fórmulas de los productos. Para separar ambos miembros se utiliza una flecha que generalmente se dirige hacia la derecha, indicando el sentido de la reacción.
Nomenclatura quimica !
Historia
La moderna Nomenclatura química tiene su origen en el Méthode de nomenclature chimique publicado en 1787 por Louis-Bernard Guyton de Morveau(1737-1816), Antoine Lavoisier (1743-1794), Claude Louis Berthollet (1748-1822) y Antoine-François de Fourcroy (1755-1809).1 Siguiendo propuestas anteriores formuladas por químicos como Bergmann y Macquer, los autores franceses adoptaron como criterio terminológico fundamental la composición química. Los elementos fueron designados con nombres simples (aunque sin ningún criterio común) y únicos, mientras que los nombres de los compuestos químicos fueron establecidos a partir de los nombres de sus elementos constituyentes más una serie de sufijos. Esta terminología se aplicó inicialmente tanto a sustancias del reino mineral como del vegetal y animal, aunque en estos últimos casos planteaba muchos problemas.
El desarrollo de la química orgánica a partir de los años treinta del siglo XIX propició la creación de nuevos términos y formas de nombrar compuestos que fueron discutidos y organizados en el congreso de Ginebra de 1892, del que surgieron muchas de las características de la terminología de la química orgánica. El otro momento decisivo en el desarrollo de la terminología química fue la creación de la IUPAC (International Union of Pure and Applied Chemistry). La sociedad surgió a partir de la Asociación Internacional de Sociedades de Química que se fundó en París en 1911 con representantes de sociedades nacionales de catorce países. De esta asociación surgieron varios grupos de trabajo encargados de estudiar nuevas propuestas de reforma de la nomenclatura química.
Tras la interrupción producida por la Primera Guerra Mundial, una nueva asociación volvió a crearse en 1919, cambiando su nombre por el de Unión Internacional de Química Pura y Aplicada (IUPAC). La guerra no sólo supuso la aparición de una nueva organización sino también la salida de las sociedades alemanas, que habían sido uno de los primeros impulsores de estas organizaciones internacionales de química. A pesar de ello, la nueva institución creció rápidamente hasta reunir en 1925 veintiocho organizaciones nacionales de química, entre las que se encontraba la española. Además, figuraban químicos representantes de diversas revistas como Chemical Abstracts estadounidense, el Journal of the Chemical Society , de Gran Bretaña, y el Bulletin Signaletique de la Société Chimique de France. Posteriormente se sumaron los editores de la Gazzeta Chimica italiana, los de la suizaHelvetica Chimica Acta y los del Recueil des Travaux Chimiques de Holanda. Finalmente, en 1930, se produjo la entrada de los representantes de las sociedades alemanas, lo que permitió que se integraran los representantes del Beilstein Handbuch de Alemania, con lo que se completó la representación de las principales revistas y de los dos repertorios de química más importantes del momento. Todos ellos, junto con los representantes de las sociedades químicas, jugarían un papel decisivo en el desarrollo de la terminología química en los años siguientes.
[editar]Sistema de nomenclatura para compuestos orgánicos
Artículo principal: Nomenclatura química de los compuestos orgánicos.
Este sistema de nomenclatura contiene las reglas y normas para nombrar a los compuestos orgánicos, moléculas compuestas esencialmente por carbono e hidrogeno enlazados con elementos como el oxígeno, boro, nitrógeno, azufre y algunos halógenos. Este sistema agrupa a la gran familia de los hidrocarburos.
[editar]Sistema de nomenclatura para compuestos inorgánicos
Artículo principal: Nomenclatura química de los compuestos inorgánicos.
Este sistema de nomenclatura agrupa y nombra a los compuestos inorgánicos, que son todos los compuestos diferentes de los orgánicos. Actualmente se aceptan tres sistemas o sub-sistemas de nomenclatura, estos son: el sistema de nomenclatura estequiométrica o sistemático, el sistema de nomenclatura funcional o clásico o tradicional y el sistema de nomenclatura Stock. Estos tres sistemas nombran a casi todos los compuestos inorgánicos, siendo la nomenclatura tradicional la más extensa, y tiene grandes ramas en el desarrollo físico y alternativo, y lleva a cabo varias interpretaciones de las funciones básicas de cada elemento.
[editar]Función química
Se llama Función química al conjunto de propiedades comunes que caracterizan a una serie de sustancias, permitiendo así diferenciarlas de las demás. Este tipo de sustancias tienen un comportamiento propio y específico en los procesos químicos. Por ejemplo:
Véase también: Propiedades químicas.
quimica inorganica :)
Química inorgánica
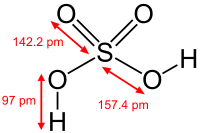
Molécula del ácido sulfúricorepresentada en 2 dimensiones,compuesto químico inorgánicomuy utilizado.
La química inorgánica se encarga del estudio integrado de la formación, composición, estructura y reacciones químicas de los elementos y compuestos inorgánicos (por ejemplo, ácido sulfúrico o carbonato cálcico); es decir, los que no poseen enlaces carbono-hidrógeno, porque éstos pertenecen al campo de la química orgánica. Dicha separación no es siempre clara, como por ejemplo en la química organometálica que es una superposición de ambas.
Antiguamente se definía como la química de la materia inorgánica, pero quedó obsoleta al desecharse lahipótesis de la fuerza vital, característica que se suponía propia de la materia viva que no podía ser creada y permitía la creación de las moléculas orgánicas. Se suele clasificar los compuestos inorgánicos según su función en ácidos, bases, óxidos y sales, y los óxidos se les suele dividir en óxidos metálicos (óxidos básicos o anhídridos básicos) y óxidos no metálicos (óxidos ácidos o anhídridos ácidos)
Campo de trabajo
El nombre tiene su origen en la época en la que todos los compuestos del carbono se obtenían de seres vivos; de ahí la química del carbono se denominaquímica orgánica. La química de compuestos sin carbono, fue, por ende, llamada química inorgánica. Actualmente, se obtienen compuestos orgánicos en el laboratorio, de forma que la separación es artificial. Algunas de las sustancias con carbono que entran en el campo de la química inorgánica incluye:
- grafito, diamante (fulereno y nanotubos se consideran más bien orgánicos)
- carbonatos y bicarbonatos
- carburo
[editar]Áreas de interés
Apartados de interés de la química inorgánica incluyen:
- La tabla periódica de los elementos:
- Química de coordinación
- Química de los compuestos con enlace metal-metal
[editar]Áreas relacionadas
Áreas de solapamiento con otros campos del conocimiento incluyen:
- Ciencia de materiales
- Geoquímica
- Magnetoquímica
- Mineralogía
- Química analítica
- Química bioinorgánica
- Química del estado sólido
- Química física
- Química medioambiental
- Química organometálica
[editar]Compuestos y sustancias importantes
Hay muchos compuestos y sustancias inorgánicas de gran importancia, comercial y biológica. Entre ellos:
- muchos fertilizantes, como el nitrato amónico, potásico, fosfatos o sulfatos...
- muchas sustancias y disolventes cotidianos, como el amoníaco, el agua oxigenada, la lejía, el salfumán
- muchos gases de la atmósfera, como el oxígeno, el nitrógeno, el dióxido de carbono, los óxidos de nitrógeno y de azufre...
- todos los metales y las aleaciones
- los vidrios de ventanas, botellas, televisores...
- las cerámicas de utensilios domésticos, industriales, o las losetas de las lanzaderas espaciales.
- el carbonato de calcio de nuestros huesos
- los chips de silicio semiconductores que hacen posible la microelectrónica y los ordenadores
- las pantallas LCD
- el cable de fibra óptica
- muchos catalizadores de interés industrial
- el centro activo de las metaloenzimas
FUERZA INTERMOLECULAR"
Fuerza intermolecular
La cohesión, también llamada fuerzas intermoleculares, fuerzas de atracción entre moléculas a veces también reciben el nombre de enlaces intermoleculares. Las fuerzas intermoleculares se definen como el conjunto de fuerzas atractivas y repulsivas que se producen entre las moléculas como consecuencia de la polaridad que poseen las moléculas. Aunque son considerablemente más débiles que los enlaces iónicos, covalentes y metálicos. Las principales fuerzas intermoleculares son:
- El enlace de hidrógeno (antiguamente conocido como puente de hidrógeno)
- Las fuerzas de Van der Waals, que podemos clasificar a su vez en:
- Dipolo - Dipolo.
- Dipolo - Dipolo inducido.
- Fuerzas de dispersión de London.
Enlace de hidrógeno
Artículo principal: Enlace por puente de hidrógeno.El enlace de hidrógeno ocurre cuando un átomo de hidrógeno es enlazado a un átomo fuertemente electronegativo como el nitrógeno, el oxígeno o elflúor.1 El átomo de hidrógeno posee una carga positiva parcial y puede interactuar con otros átomos electronegativos en otra molécula (nuevamente, con N, O o F). Así mismo, se produce un cierto solapamiento entre el H y el átomo con que se enlaza (N, O o F) dado el pequeño tamaño de estas especies. Por otra parte, cuanto mayor sea la diferencia de electronegatividad entre el H y el átomo interactuante, más fuerte será el enlace. Fruto de estos presupuestos obtenemos un orden creciente de intensidad del enlace de hidrógeno: el formado con el F será de mayor intensidad que el formado con el O, y éste a su vez será más intenso que el formado con el N. Estos fenómenos resultan en una interacción estabilizante que mantiene ambas moléculas unidas. Un ejemplo claro del enlace de hidrógeno es el agua:Los enlaces de hidrógeno se encuentran en toda la naturaleza. Proveen al agua de sus propiedades particulares, las cuales permiten el desarrollo de la vida en la Tierra. Los enlaces de hidrógeno proveen también la fuerza intermolecular que mantiene unidas ambas hebras en una molécula de ADN.Es un tipo especial de interacción dipolo-dipolo entre el átomo de hidrógeno que está formando un enlace polar, tal como N—H, O—H, ó F—H, y un átomo electronegativo como O, N ó F. Esta interacción se representa de la siguiente forma:A—H•••B A—H•••AA y B representan O, ó F; A—H es una molécula o parte de una molécula y B es parte de otra. La línea de puntos representa el enlace de hidrógeno.La energía media de un enlace de hidrógeno es bastante grande para ser una interacción dipolo-dipolo (mayor de 40 KJ/mol). Esto hace que el enlace de hidrógeno sea una de gran importancia a la hora de la adopción de determinadas estructuras y en las propiedades de muchos compuestos.Las primeras evidencias de la existencia de este tipo de interacción vinieron del estudio de los puntos de ebullición. Normalmente, los puntos de ebullición de compuestos que contienen a elementos del mismo grupo aumentan con el peso molecular. Pero, como se puede observar en la figura, los compuestos de los elementos de los Grupos 15, 16 y 17 no siguen esta norma. Para cada uno de los grupos, los compuestos de menos peso molecular (NH3, H2O, HF) tienen el punto de ebullición más alto, en contra de lo que se podría esperar en principio. Ello es debido a que existe algún tipo de interacción entre las moléculas en estado líquido que se opone al paso al estado de vapor. Esa interacción es el enlace de hidrógeno, y afecta a los primeros miembros de la serie pues son los más electronegativos, y por ello el enlace X-H es el más polarizado, lo que induce la mayor interacción por puente de hidrógeno. Los puentes de hidrógeno son especialmente fuertes entre las moléculas de agua y son la causa de muchas de las singulares propiedades de esta sustancia. Los compuestos de hidrógeno de elementos vecino al oxígeno y de los miembros de su familia en la tabla periódica, son gases a la temperatura ambiente: CH4, NH3, H2S, H2Te, PH3, HCl. En cambio, el H2O es líquida a la temperatura ambiente, lo que indica un alto grado de atracción intermolecular. En la figura se puede ver que el punto de ebullición del agua es 100 °C más alto de lo que cabría predecir si no hubiera puentes de hidrógeno. Los puentes de hidrógeno juegan también un papel crucial en la estructura del ADN, la molécula que almacena la herencia genética de todos los seres vivos.[cita requerida][editar]Fuerza de Van der Waals
Artículo principal: Fuerzas de Van der Waals.También conocidas como fuerzas de dispersión, de London o fuerzas dipolo-transitivas, corresponden a las interacciones entre moléculas con enlaces covalentes apolares debido a fenómenos de polarización temporal. Estas fuerzas se explican de la siguiente forma: como las moléculas no tienen carga eléctrica neta, en ciertos momentos, se puede producir una distribución en la que hay mayor densidad de electrones en una región que en otra, por lo que aparece un dipolo momentáneo.Cuando dos de estas moléculas polarizadas y orientadas convenientemente se acercan lo suficiente entre ambas, pude ocurrir que las fuerzas eléctricas atractivas sean lo bastante intensas como para crear uniones intermoleculares. Estas fuerzas son muy débiles y se incrementan con el tamaño de las moléculas.
ENLACE MATLICO!
Enlace metálico
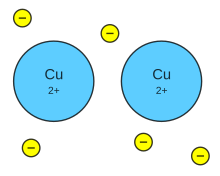
Enlace metálico en el Cobre.
Un enlace metálico es un enlace químico que mantiene unidos los átomos (unión entre núcleos atómicos y los electrones de valencia, que se juntan alrededor de éstos como una nube) de los metales entre sí. Estos átomos se agrupan de forma muy cercana unos a otros, lo que produce estructuras muy compactas. Se trata de líneas tridimensionales que adquieren estructuras tales como: la típica de empaquetamiento compacto de esferas (hexagonal compacta), cúbica centrada en las caras o la cúbica centrada en el cuerpo. En este tipo de estructura cada átomo metálico está dividido por otros doce átomos (seis en el mismo plano, tres por encima y tres por debajo). Además, debido a la baja electronegatividad que poseen los metales, los electrones de valencia son extraídos de sus orbitales. Este enlace sólo puede estar en sustancias en estado sólido.1
Los metales poseen algunas propiedades características que los diferencian de los demás materiales. Suelen ser sólidos a temperatura ambiente, excepto el mercurio, y tienen un punto de fusión alto.
El enlace metálico es característico de los elementos metálicos. Es un enlace fuerte, primario, que se forma entre elementos de la misma especie. Al estar los átomos tan cercanos unos de otros, interaccionan sus núcleos junto con sus nubes electrónicas, empaquetándose en las tres dimensiones, por lo que quedan los núcleos rodeados de tales nubes. Estos electrones libres son los responsables de que los metales presenten una elevada conductividad eléctrica y térmica, ya que estos se pueden mover con facilidad si se ponen en contacto con una fuente eléctrica. Los metales generalmente presentan brillo y son maleables. Los elementos con un enlace metálico están compartiendo un gran número de electrones de valencia, formando un mar de electrones rodeando un enrejado gigante de cationes. Muchos de los metales tienen puntos de fusión más altos que otros elementos no metálicos, por lo que se puede inferir que hay enlaces más fuertes entre los distintos átomos que los componen. La vinculación metálica es no polar, apenas hay diferencia de electronegatividad entre los átomos que participan en la interacción de la vinculación (en los metales, elementales puros) o muy poca (en las aleaciones), y los electrones implicados en lo que constituye la interacción a través de la estructura cristalina del metal. El enlace metálico explica muchas características físicas de metales, tales como maleabilidad, ductilidad, buenos en la conducción de calor y electricidad, y con brillo o lustre (devuelven la mayor parte de la energía lumínica que reciben).
La vinculación metálica es la atracción electrostática entre los átomos del metal o cationes y los electrones deslocalizados. Esta es la razón por la cual se puede explicar un deslizamiento de capas, dando por resultado su característica maleabilidad y ductilidad.
Los átomos del metal tienen por lo menos un electrón de valencia, no comparten estos electrones con los átomos vecinos, ni pierden electrones para formar los iones. En lugar los niveles de energía externos de los átomos del metal se traslapan. Son como enlaces covalentes identificados.
ENLACE COVALENTE !
ENLACE COVALENTE
Un enlace covalente entre dos átomos o grupos de átomos se produce cuando estos, para alcanzar el octeto estable, comparten electrones del último nivel.1 La diferencia de electronegatividades entre los átomos no es suficiente
De esta forma, los dos átomos comparten uno o más pares electrónicos en un nuevo tipo de orbital, denominado orbital molecular. Los enlaces covalentes se suelen producir entre elementos gaseosos ono metales.
El Enlace Covalente se presenta cuando dos átomos comparten electrones para estabilizar la unión.
A diferencia de lo que pasa en un enlace iónico, en donde se produce la transferencia de electrones de un átomo a otro; en el enlace covalente, los electrones de enlace son compartidos por ambos átomos. En el enlace covalente, los dos átomos no metálicos comparten uno o más electrones, es decir se unen a través de sus electrones en el último orbital, el cual depende del número atómico en cuestión. Entre los dos átomos pueden compartirse uno, dos o tres pares de electrones, lo cual dará lugar a la formación de un enlace simple, doble o triple respectivamente. En la representación de Lewis, estos enlaces pueden representarse por una pequeña línea entre los átomos.
Tipos de sustancias covalentes
Existen dos tipos de sustancias covalentes:
Sustancias covalentes moleculares: los enlaces covalentes forman moléculas que tienen las siguientes propiedades:
- Temperaturas de fusión y ebullición bajas.
- En condiciones normales de presión y temperatura (25 °C aprox.) pueden ser sólidos, líquidos o gaseosos
- Son blandos en estado sólido.
- Son aislantes de corriente eléctrica y calor.
- Solubilidad: las moléculas polares son solubles en disolventes polares y las apolares son solubles en disolventes apolares (semejante disuelve a semejante).
Redes o Sustancias covalentes reticulares: Además las sustancias covalentes forman redes, semejantes a los compuestos iónicos, que tienen estas propiedades:
- Elevadas temperaturas de fusión y ebullición.
- Son sólidos .
- Son sustancias muy duras (excepto el grafito).
- Son aislantes (excepto el grafito) .
- Son insolubles .
- Son neocloridas.
Moléculas poliatómicas
Artículo principal: Anexo:Enlace en moléculas poliatómicas.
Definición del enlace covalente
Considérense átomos de hidrógeno, a medida que se aproximan entre sí, se van haciendo notar las fuerzas que atraen a cada electrón al núcleo del otro átomo, hasta que dichas fuerzas de atracción se llegan a compensar con la repulsión que los electrones sienten entre sí. En ese punto, la molécula presenta la configuración más estable.
Lo que ha sucedido es que los orbitales de ambos electrones se han translapado, de modo que ahora es imposible distinguir a qué átomo pertenece cada uno de los electrones.
Sin embargo, cuando los átomos son distintos, los electrones compartidos no serán atraídos por igual, de modo que estos tenderán a aproximarse hacia el átomo más electronegativo, es decir, aquel que tenga una mayor apetencia de electrones. Este fenómeno se denomina polaridad (los átomos con mayor electronegatividad obtienen una polaridad más negativa, atrayendo los electrones compartidos hacia su núcleo), y resulta en un desplazamiento de las cargas dentro de la molécula.
Se podría decir que al átomo más electronegativo no le gusta mucho compartir sus electrones con los demás átomos, y en el caso más extremo, deseará que el electrón le sea cedido sin condiciones formándose entonces un enlace iónico, de ahí que se diga que los enlaces covalentes polares tienen, en alguna medida, carácter iónico.
Suscribirse a:
Entradas (Atom)




